Вход / Регистрация
21.02.2026, 22:11
Вирусы-химеры привели к созданию бионанороботов
В 1985 году американский биолог Джордж Смит предложил идею фагового дисплея — быстрого поиска веществ, которые могут стать основой лекарства, и доказал ее работоспособность. Его идея превратилась не просто в биоинженерный метод, а в концепцию, заменившую во многих случаях метод проб и ошибок. В этом году ученому присуждена Нобелевская премия по химии. Об истории открытия РИА Новости рассказал Валерий Петренко, профессор Обернского университета (США), соавтор Смита.
Опыты с бактериофагом
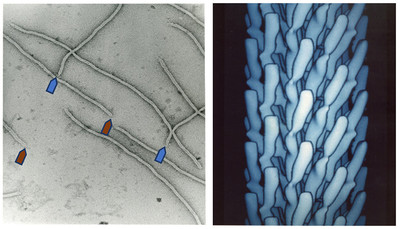
В середине 1970-х появились технологии генной инженерии, которые позволили вставлять в геном чужеродные гены, чтобы смотреть, какие белки при этом вырабатываются. Наиболее удобным объектом для работы служили вирусы. По сути, это куски РНК или ДНК, которые размножаются только внутри живой клетки. В оболочку вируса можно вставить измененное или даже чужое ДНК, потом заразить им колонию бактерий и таким образом размножить. Паразитирующие на бактериях вирусы называются бактериофагами.
"В 1980-х я работал в ГНЦ "Вектор" в Новосибирской области. Бактериофаги интересовали меня в качестве источника иммуногенов — веществ, которые вызывают ответ иммунной системы. Перед нами стояла задача создать диагностику и вакцину от ВИЧ и других вирусов", — рассказывает Валерий Петренко.
В "Векторе" располагалась прекрасно оборудованная лаборатория, в которой работал молодой коллектив талантливых аспирантов и сотрудников. Они занимались синтезом олигонуклеотидов — небольших участков ДНК или РНК, направленным мутагенезом, расшифровкой генома, осваивали новые методы генной инженерии.
Петренко раздобыл статью Джорджа Смита 1985 года, где излагались результаты работы с нитчатым бактериофагом. Внешне он похож на волокно, покрытое белковой оболочкой. В работе Смита описывалась идея, как путем генной инженерии сделать вирус-химеру, который бы вырабатывал на оболочке чужеродный белок. Для этого в участок ДНК фага, кодирующий оболочечный белок, вставляли чужой (или случайный) ген. В результате оба белка — свой и чужой — свивались вместе и проявлялись на поверхности как некий гибридный белок (точнее пептид, поскольку его молекула очень короткая). Такой пептид легко исследовать, например, изучать его сродство с различными молекулами. Бактериофаг с проглядывающими на оболочке пептидами называют фаговым дисплеем.
Петренко решил усовершенствовать метод Смита и взял образец нитчатого бактериофага в соседнем институте. В лаборатории выяснилось, что микроб в пробирке высох. Оживить его не удалось — только выделить ДНК. Этого было достаточно, чтобы методом трансфекции (вставки чужого гена в геном бактерии) клонировать вирус.
"Когда я на ученом совете заявил тему для аспирантки Ольги Миненковой — "получение белка на оболочке фага для создания новых структур", мне не хотели верить. Но Ольга — феноменальный специалист, и работа была выполнена. Я назову всех, кто участвовал: Александр Ильичев, Григорий Кищенко, Сергей Татьков, Николай Карпышев, Алексей Ерошкин, Вячеслав Офицеров, Зоя Акименко, Владимир Каргинов, Алла Корепанова и другие сотрудники института. Директор "Вектора" Лев Степанович Сандахчеев сразу понял наши идеи и поддержал. Я хочу его роль особо отметить. Благодаря ему мы имели возможность заниматься этим направлением", — продолжает Валерий Александрович.
Метод Смита позволял на оболочке вируса "вырастить" всего несколько нитей чужого пептида. Группа Петренко добилась того, что бактериофаг оказался полностью "переодет" в чужеродную белковую оболочку. Это означало, что на вирусе можно вырастить практически любой материал.
"Когда я на ученом совете заявил тему для аспирантки Ольги Миненковой — "получение белка на оболочке фага для создания новых структур", мне не хотели верить. Но Ольга — феноменальный специалист, и работа была выполнена. Я назову всех, кто участвовал: Александр Ильичев, Григорий Кищенко, Сергей Татьков, Николай Карпышев, Алексей Ерошкин, Вячеслав Офицеров, Зоя Акименко, Владимир Каргинов, Алла Корепанова и другие сотрудники института. Директор "Вектора" Лев Степанович Сандахчеев сразу понял наши идеи и поддержал. Я хочу его роль особо отметить. Благодаря ему мы имели возможность заниматься этим направлением", — продолжает Валерий Александрович.
Метод Смита позволял на оболочке вируса "вырастить" всего несколько нитей чужого пептида. Группа Петренко добилась того, что бактериофаг оказался полностью "переодет" в чужеродную белковую оболочку. Это означало, что на вирусе можно вырастить практически любой материал.

Пионеры ландшафтного фагового дисплея в России (слева направо): Григорий Кищенко, Сергей Татьков, Александр Ильичев, Галина Кузмичева, Валерий Петренко, Ольга Миненкова. ГНЦ "Вектор", Новосибирск, 1991 год
Нанотехнологический прорыв
Петренко с коллегами опубликовали несколько статей по итогам экспериментов, в том числе в 1993 году в журнале "Gene". Последовали доклады на конференциях и приглашения в лучшие зарубежные университеты.
Валерий Петренко занял должность сначала приглашенного профессора, а затем профессора-исследователя в Миссурийском университете (США). Там в лаборатории первооткрывателя метода Джорджа Смита он работал семь лет.
"Это удивительный человек. Настоящий ученый с колоссальным воображением. Я не встречал, кто бы так вдохновенно относился к науке. Когда я узнал о присуждении ему Нобелевской премии, я был счастлив и горд, что имел возможность работать с ним, учиться у него", — характеризует Смита Петренко.
Джордж Смит занимался иммунологией — изучением работы защитных сил организма. Когда в кровь или слизистые попадает чужеродный микроб или частицы, организм распознает их как врагов и начинает бороться путем выбрасывания в кровь антител — особых белков-киллеров.
Прирожденные убийцы: почему бактерии выигрывают в борьбе с антибиотиками
Антитело распознает врага и начинает противодействовать ему тем или иным способом. Многие лекарства представляют собой человеческие, чужеродные или искусственные антитела, которые помогают иммунитету бороться с заболеванием. На поиски нужной молекулы методом проб и ошибок уходит много времени. Но Смит показал, что поиск можно значительно ускорить, если создавать библиотеки фаговых ДНК. Для этого он синтезировал миллиарды случайных фрагментов вирусных ДНК, каждый из которых нес информацию об одном пептиде. С помощью бактерий клонировал многомиллиардную популяцию фагов, несущих на оболочках совершенно разные, случайные, пептиды.
Получившуюся фаговую библиотеку добавляют, например, в чашку Петри, где находится раствор изучаемых молекул. Через какое-то время, образец промывают и смотрят, какие фаги "прицепились" пептидами к молекулам.
Чтобы узнать ген, отвечающий за этот пептид, нужно секвенировать геном фага, что легко сделать с современным оборудованием. Фактически ученый задает вопрос: "для чего годится эта молекула" и находит в библиотеке ответ.
"Смит рассылал свои библиотеки коллегам совершенно бескорыстно, чтобы люди опробовали метод. В этом колоссальная его заслуга, он действовал как проповедник нового метода. Потом уже появились компании, которые занялись их коммерческим производством. А Смит предложил парадигму — новый способ мышления", — говорит Петренко.
В его совместной с Джорджем Смитом книге изложена эволюция метода фаговых дисплеев, который нашел множество применений и ускорил наступление эры нанобиотехнологии.
Сейчас Валерий Петренко занимается созданием антираковых препаратов нового поколения.
"Мы называем это "беспилотными" препаратами направленного действия, или smart-machines. Они представляют собой частицы — носители лекарства. Их вводят в кровь, и специальные белки помогают им достичь раковой опухоли. Это уже наномедицина", — заключает ученый.
Валерий Петренко занял должность сначала приглашенного профессора, а затем профессора-исследователя в Миссурийском университете (США). Там в лаборатории первооткрывателя метода Джорджа Смита он работал семь лет.
"Это удивительный человек. Настоящий ученый с колоссальным воображением. Я не встречал, кто бы так вдохновенно относился к науке. Когда я узнал о присуждении ему Нобелевской премии, я был счастлив и горд, что имел возможность работать с ним, учиться у него", — характеризует Смита Петренко.
Джордж Смит занимался иммунологией — изучением работы защитных сил организма. Когда в кровь или слизистые попадает чужеродный микроб или частицы, организм распознает их как врагов и начинает бороться путем выбрасывания в кровь антител — особых белков-киллеров.
Прирожденные убийцы: почему бактерии выигрывают в борьбе с антибиотиками
Антитело распознает врага и начинает противодействовать ему тем или иным способом. Многие лекарства представляют собой человеческие, чужеродные или искусственные антитела, которые помогают иммунитету бороться с заболеванием. На поиски нужной молекулы методом проб и ошибок уходит много времени. Но Смит показал, что поиск можно значительно ускорить, если создавать библиотеки фаговых ДНК. Для этого он синтезировал миллиарды случайных фрагментов вирусных ДНК, каждый из которых нес информацию об одном пептиде. С помощью бактерий клонировал многомиллиардную популяцию фагов, несущих на оболочках совершенно разные, случайные, пептиды.
Получившуюся фаговую библиотеку добавляют, например, в чашку Петри, где находится раствор изучаемых молекул. Через какое-то время, образец промывают и смотрят, какие фаги "прицепились" пептидами к молекулам.
Чтобы узнать ген, отвечающий за этот пептид, нужно секвенировать геном фага, что легко сделать с современным оборудованием. Фактически ученый задает вопрос: "для чего годится эта молекула" и находит в библиотеке ответ.
"Смит рассылал свои библиотеки коллегам совершенно бескорыстно, чтобы люди опробовали метод. В этом колоссальная его заслуга, он действовал как проповедник нового метода. Потом уже появились компании, которые занялись их коммерческим производством. А Смит предложил парадигму — новый способ мышления", — говорит Петренко.
В его совместной с Джорджем Смитом книге изложена эволюция метода фаговых дисплеев, который нашел множество применений и ускорил наступление эры нанобиотехнологии.
Сейчас Валерий Петренко занимается созданием антираковых препаратов нового поколения.
"Мы называем это "беспилотными" препаратами направленного действия, или smart-machines. Они представляют собой частицы — носители лекарства. Их вводят в кровь, и специальные белки помогают им достичь раковой опухоли. Это уже наномедицина", — заключает ученый.