Вход / Регистрация
12.03.2026, 17:31
Шагающий белок Миозин
Еще в 2007 году японские исследователи сумели пронаблюдать под
микроскопом работу одного из «молекулярных моторов» живой клетки —
шагающего белка миозина V, который умеет активно передвигаться вдоль
актиновых волокон и перетаскивать прикрепленные к нему грузы. Каждый шаг
миозина V начинается с того, что одна из его «ног» (задняя) отделяется
от актиновой нити.
Затем вторая нога наклоняется вперед, а первая свободно вращается на «шарнире», соединяющем ноги молекулы, до тех пор, пока случайно не коснется актиновой нити. Конечный итог хаотического движения первой ноги оказывается строго детерминирован благодаря фиксированному положению второй.
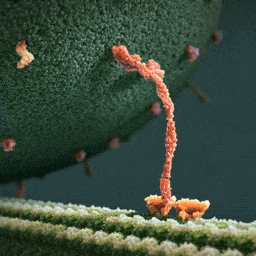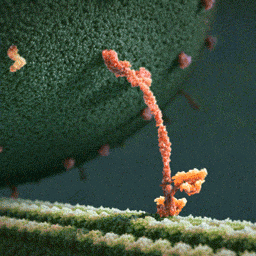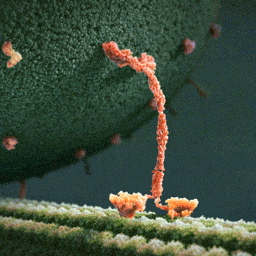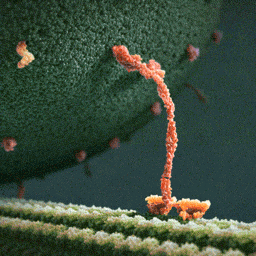
Затем вторая нога наклоняется вперед, а первая свободно вращается на «шарнире», соединяющем ноги молекулы, до тех пор, пока случайно не коснется актиновой нити. Конечный итог хаотического движения первой ноги оказывается строго детерминирован благодаря фиксированному положению второй.

В основе любых активных движений, совершаемых живыми организмами (от движения хромосом при клеточном делении до мышечных сокращений), лежит работа «молекулярных моторов» — белковых комплексов, части которых способны двигаться друг относительно друга. У высших организмов важнейшими из молекулярных моторов служат молекулы миозина разных типов (I, II, III и т. д., вплоть до XVII), способные активно передвигаться вдоль актиновых волокон.
Многие «молекулярные моторы», в том числе миозин V, используют принцип шагающего движения. Они передвигаются дискретными шажками примерно одинаковой длины, причем впереди оказывается попеременно то одна, то другая из двух «ног» молекулы. Однако многие детали этого процесса остаются неясными.Сотрудники физического факультета университета Васэда (Department of Physics, Waseda University) в Токио разработали методику, позволяющую наблюдать за работой миозина V в реальном времени под микроскопом. Для этого они сконструировали модифицированный миозин V, у которого стержни ног обладают свойством накрепко «приклеиваться» к тубулиновым микротрубочкам.
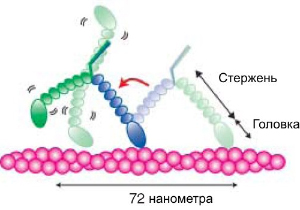
Многие «молекулярные моторы», в том числе миозин V, используют принцип шагающего движения. Они передвигаются дискретными шажками примерно одинаковой длины, причем впереди оказывается попеременно то одна, то другая из двух «ног» молекулы. Однако многие детали этого процесса остаются неясными.Сотрудники физического факультета университета Васэда (Department of Physics, Waseda University) в Токио разработали методику, позволяющую наблюдать за работой миозина V в реальном времени под микроскопом. Для этого они сконструировали модифицированный миозин V, у которого стержни ног обладают свойством накрепко «приклеиваться» к тубулиновым микротрубочкам.

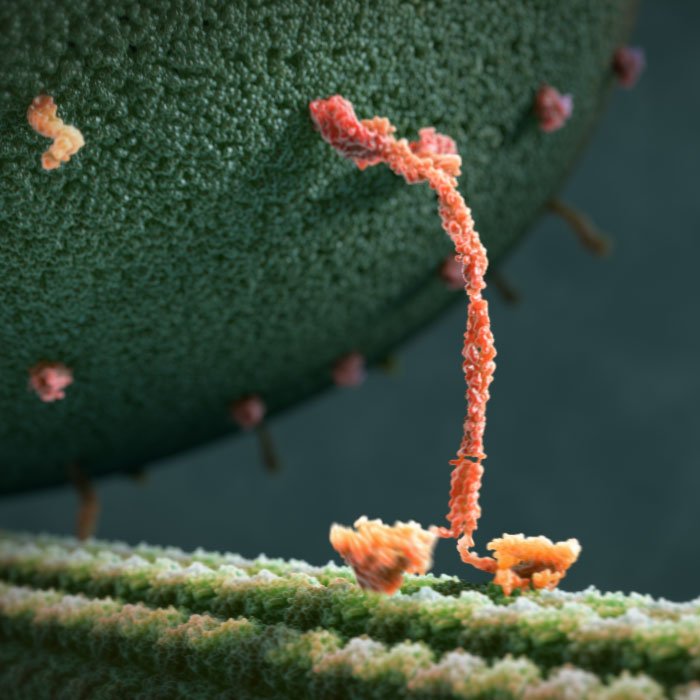
Так миозин V шагает по актиновой нити. Движение происходит справа налево. Сначала одна из «ног» миозина (зеленая) отделяется от актиновой нити, затем другая нога (синяя) наклоняется вперед. После этого зеленая нога хаотически вращается на шарнире до тех пор, пока не наткнется на актиновую нить. Рис. из обсуждаемой статьи в Science
Добавляя в раствор модифицированного миозина V фрагменты микротрубочек, ученые получили несколько комплексов, в которых кусок микротрубочки приклеился только к одной ноге миозина V, а вторая осталась свободной. Эти комплексы сохранили способность «шагать» по актиновым волокнам, и за их движениями можно было наблюдать, поскольку фрагменты микротрубочек гораздо крупнее самого миозина, и к тому же их метили флуоресцирующими метками. При этом использовали два экспериментальных дизайна: в одном случае фиксировали в пространстве актиновое волокно, а наблюдения вели за движением фрагмента микротрубочки, а во втором фиксировали микротрубочку и наблюдали за движением фрагмента актинового волокна.
Добавляя в раствор модифицированного миозина V фрагменты микротрубочек, ученые получили несколько комплексов, в которых кусок микротрубочки приклеился только к одной ноге миозина V, а вторая осталась свободной. Эти комплексы сохранили способность «шагать» по актиновым волокнам, и за их движениями можно было наблюдать, поскольку фрагменты микротрубочек гораздо крупнее самого миозина, и к тому же их метили флуоресцирующими метками. При этом использовали два экспериментальных дизайна: в одном случае фиксировали в пространстве актиновое волокно, а наблюдения вели за движением фрагмента микротрубочки, а во втором фиксировали микротрубочку и наблюдали за движением фрагмента актинового волокна.

В итоге «походку» миозина V удалось изучить в больших подробностях (см. первый рисунок). Каждый шаг начинается с того, что «задняя» нога миозина отделяется от актинового волокна. Затем та нога, которая осталась прикрепленной к волокну, резко наклоняется вперед. Именно в этот момент расходуется энергия (происходит гидролиз АТФ). После этого «свободная» нога (на рисунках — зеленая) начинает хаотически болтаться на шарнире. Это не что иное, как броуновское движение. Заодно, кстати, ученым удалось впервые показать, что шарнир, соединяющий ноги миозина V, совершенно не стесняет их движений. Рано или поздно зеленая нога касается своим концом актиновой нити и прикрепляется к ней. Место, где она прикрепится к нити (и, следовательно, длина шага) полностью определяются фиксированным наклоном синей ноги.
В эксперименте поиск актиновой нити свободной ногой миозина V занимал несколько секунд; в живой клетке это, видимо, происходит быстрее, поскольку там миозин шагает без гирь на ногах. Грузы — например, внутриклеточные пузырьки, окруженные мембранами — крепятся не к ногам, а к той части молекулы, которая на рисунке изображена как «хвостик».
В эксперименте поиск актиновой нити свободной ногой миозина V занимал несколько секунд; в живой клетке это, видимо, происходит быстрее, поскольку там миозин шагает без гирь на ногах. Грузы — например, внутриклеточные пузырьки, окруженные мембранами — крепятся не к ногам, а к той части молекулы, которая на рисунке изображена как «хвостик».