Вход / Регистрация
07.03.2026, 08:58
Ученые из России нашли способ отложить клеточную смерть
Учёные из МГУ имени М. В. Ломоносова и Института теоретической и экспериментальной биофизики РАН (г. Пущино) выяснили, как замедлить взаимодействие «рецепторов смерти» в клетках тканей.
Учёные из МГУ имени М.В. Ломоносова и Института теоретической и экспериментальной биофизики РАН (г. Пущино) исследовали механизмы взаимодействия белка Fas-лиганд, вызывающего гибель клеток, с соответствующим рецептором на мембране. Оказалось, что для запуска драматического сценария ему необходим контакт с особым белковым компонентом клетки кавеолином. Гибель можно предотвратить путём удаления из молекулы белка Fas-лиганда стыковочного участка. Результаты работы опубликованы в журнале Cell Death & Disease.
Fas-лиганд принадлежит к семейству факторов некроза опухоли. Основная их задача — запускать клеточную гибель, которая происходит в результате взаимодействия с «рецепторами смерти», расположенными на поверхности мембраны. Такой контакт запускает целый каскад разрушительных для клетки реакций, оканчивающихся её гибелью — апоптозом.
«Мы рассматривали механизмы взаимодействия Fas-лиганда с его рецептором и обнаружили, что для проявления активности необходим мембранный белок кавеолин, способный присоединяться к Fas-лиганду. Удаление из лиганда участков связывания с кавеолином значительно снижает его токсичность для клеток. Эксперименты проходили с использованием традиционных методов клеточной и молекулярной биологии», — рассказывает Владимир Гогвадзе, доктор биологических наук, ведущий научный сотрудник лаборатории исследования механизмов апоптоза факультета фундаментальной медицины МГУ.
Учёные из МГУ имени М.В. Ломоносова и Института теоретической и экспериментальной биофизики РАН (г. Пущино) исследовали механизмы взаимодействия белка Fas-лиганд, вызывающего гибель клеток, с соответствующим рецептором на мембране. Оказалось, что для запуска драматического сценария ему необходим контакт с особым белковым компонентом клетки кавеолином. Гибель можно предотвратить путём удаления из молекулы белка Fas-лиганда стыковочного участка. Результаты работы опубликованы в журнале Cell Death & Disease.
Fas-лиганд принадлежит к семейству факторов некроза опухоли. Основная их задача — запускать клеточную гибель, которая происходит в результате взаимодействия с «рецепторами смерти», расположенными на поверхности мембраны. Такой контакт запускает целый каскад разрушительных для клетки реакций, оканчивающихся её гибелью — апоптозом.
«Мы рассматривали механизмы взаимодействия Fas-лиганда с его рецептором и обнаружили, что для проявления активности необходим мембранный белок кавеолин, способный присоединяться к Fas-лиганду. Удаление из лиганда участков связывания с кавеолином значительно снижает его токсичность для клеток. Эксперименты проходили с использованием традиционных методов клеточной и молекулярной биологии», — рассказывает Владимир Гогвадзе, доктор биологических наук, ведущий научный сотрудник лаборатории исследования механизмов апоптоза факультета фундаментальной медицины МГУ.
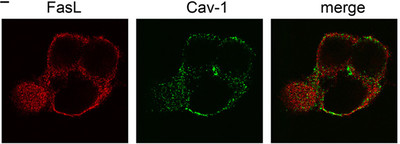
Расположение флуоресцентно меченных Fas-лигандов (Fas-L) и кавеолина (Cav-1) в клетке. Последнее изображение — наложение каналов Fas-L и Cav-1 (merge). Получено методом лазерной конфокальной сканирующей микроскопии
В клетке Fas-лиганды могут существовать в растворённом виде в цитоплазме или же входить в состав мембраны, пересекая или пронизывая её насквозь. В последнем случае в Fas-лиганде можно выделить внеклеточную, внутриклеточную и погруженную в толщу мембраны части. Внеклеточная отвечает за узнавание соответствующего рецептора, функции погруженной пока неизвестны. Внутриклеточная же участвует в транспортных и сигнальных процессах, а также перемещении лиганда в состав мембранных рафтов, сформированных собранными вокруг белка кавеолина молекулами холестерина, и сфинголипидов. Сам факт того, что для активации запуска апоптоза Fas-лиганд обязательно должен находиться в составе рафта, наводит на мысль о его возможных взаимодействиях с компонентами мембранного окружения.
Действительно, расшифровка аминокислотной последовательности Fas-лиганда позволила выявить у него наличие особых участков, избирательно связывающихся с кавеолином. Эксперименты, проведённые на мутантных клетках, не содержащих такие стыковочные фрагменты, полностью подтвердили догадку: не имея возможности взаимодействовать с кавеолином, белок Fas-лиганд терял свою убийственную активность, и его токсичность для живых клеток снижалась. Уже известно, что кавеолин способен подавлять развитие опухоли. В свете полученных исследователями данных можно предположить, что большую роль в этом играет именно связь с Fas-лигандом. Такой механизм заставляет дефектные, потенциально раковые клетки вступить на путь апоптоза.
«Главная ценность нашей работы состоит в раскрытии механизмов стимуляции клеточной гибели. Это позволит в дальнейшем выработать новые стратегии лечения онкологических заболеваний», — заключает Владимир Гогвадзе.
В клетке Fas-лиганды могут существовать в растворённом виде в цитоплазме или же входить в состав мембраны, пересекая или пронизывая её насквозь. В последнем случае в Fas-лиганде можно выделить внеклеточную, внутриклеточную и погруженную в толщу мембраны части. Внеклеточная отвечает за узнавание соответствующего рецептора, функции погруженной пока неизвестны. Внутриклеточная же участвует в транспортных и сигнальных процессах, а также перемещении лиганда в состав мембранных рафтов, сформированных собранными вокруг белка кавеолина молекулами холестерина, и сфинголипидов. Сам факт того, что для активации запуска апоптоза Fas-лиганд обязательно должен находиться в составе рафта, наводит на мысль о его возможных взаимодействиях с компонентами мембранного окружения.
Действительно, расшифровка аминокислотной последовательности Fas-лиганда позволила выявить у него наличие особых участков, избирательно связывающихся с кавеолином. Эксперименты, проведённые на мутантных клетках, не содержащих такие стыковочные фрагменты, полностью подтвердили догадку: не имея возможности взаимодействовать с кавеолином, белок Fas-лиганд терял свою убийственную активность, и его токсичность для живых клеток снижалась. Уже известно, что кавеолин способен подавлять развитие опухоли. В свете полученных исследователями данных можно предположить, что большую роль в этом играет именно связь с Fas-лигандом. Такой механизм заставляет дефектные, потенциально раковые клетки вступить на путь апоптоза.
«Главная ценность нашей работы состоит в раскрытии механизмов стимуляции клеточной гибели. Это позволит в дальнейшем выработать новые стратегии лечения онкологических заболеваний», — заключает Владимир Гогвадзе.