Что такое металлопротеины?
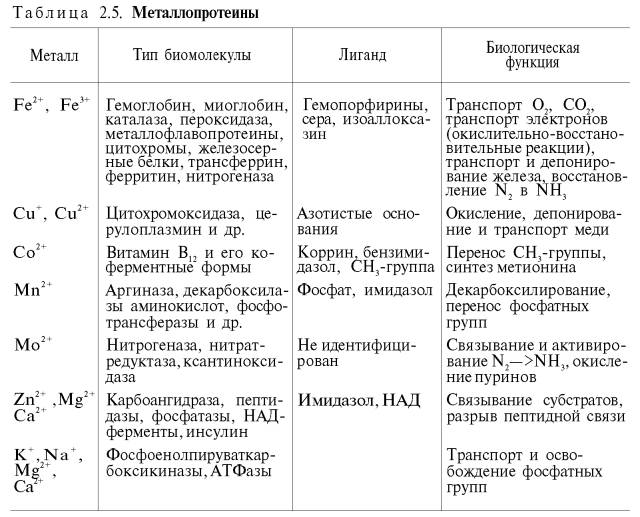
К металлопротеинам относятся биополимеры, содержащие, помимо белка, ионы какого-либо одного металла или нескольких металлов (табл. 2.5). К таким белкам принадлежат, например, белки, содержащие негемовое железо, а также белки, координационно связанные с атомами металлов в составе сложных белков-ферментов.
Типичными представителями первых являются железосодержащие белки ферритин, трансферрин и гемосидерин. Ферритин – высокомолекулярный водорастворимый белок с мол. массой 400000, в котором содержание железа составляет от 17 до 23% (в среднем 20%). Он сосредоточен главным образом в селезенке, печени, костном мозге, выполняя роль депо железа в организме. Железо в ферритине находится в окисленной форме, в составе неорганического железосодержащего соединения (FeO•OH)8•(FeO•O•PO3H2), причем цепи неорганического полимера O=Fe—OH...O=Fe—ОН..., иногда содержащие фосфаты, находятся между пептидными цепями белковой части (называемая апоферритином), а атомы железа координационно связываются с атомами азота пептидных групп.
Трансферрин – растворимый в воде железопротеин (мол. масса 90000), гликопротеин, обнаруживаемый главным образом в сыворотке крови в составе β-глобулинов. Содержание железа в нем составляет 0,13%. Предполагают, что атом железа соединяется с белком координационными связями с участием гидроксильных групп тирозина. Молекула трансфер-рина содержит 2 атома железа; трансферрин служит физиологическим переносчиком железа в организме.
Гемосидерин в отличие от ферритина и трансферрина является водонерастворимым железосодержащим белковым комплексом, состоящим, кроме того, на 25% из нуклеотидов и углеводов. Он содержится главным образом в ретикулоэндотелиоцитах печени и селезенки. Биологическая роль гемосидерина изучена недостаточно.
Ко второй группе металлопротеинов относится ряд ферментов: ферменты, содержащие связанные с молекулой белка ионы металлов, определяющих их функцию,– металлоферменты (в процессе очистки металлы остаются связанными с ферментами); ферменты, активируемые ионами металлов, менее прочно связаны с металлами, но для проявления своей активности нуждаются в добавлении в реакционную среду определенного металла. Предполагают, что механизмы участия металла в акте катализа в обоих случаях, вероятнее всего, сходны; ионы металла участвуют в образовании тройного комплекса: активный центр фермента–ме-талл–субстрат (Е—М—S), или М—Е—S, или Е—S—М. Есть доказательства, что в активном центре многих ферментов в связывании металла участвует имидазольная группа гистидина.