Вход / Регистрация
21.02.2026, 13:18
Гениальность Дмитрия Менделеева
Таблица Менделеева известна каждому, и сегодня ее можно встретить практически повсюду. Что же сделало ее такой знаменитой? Если вы думаете, что известность Менделееву принес лишь список элементов, то вы заблуждаетесь. Хотите знать правду? — смотрите ролик!
О том, что представляет собой таблица Менделеева в её современном понимании, можно прочесть дальше:
СОВРЕМЕННАЯ ФОРМА ТАБЛИЦЫ МЕНДЕЛЕЕВА
Доктор технических наук Р. САЙФУЛЛИН, профессор, действительный член Академии наук Республики Татарстан; кандидат химических наук А. САЙФУЛЛИН
В этом году исполняется 170 лет со дня рождения выдающегося российского химика Дмитрия Ивановича Менделеева и 135 лет со дня создания им периодической системы элементов. За истекшее время таблица, наглядно демонстрирующая периодический закон, неоднократно дополнялась и расширялась. До последнего времени в научной и учебной литературе приводилась так называемая короткая форма таблицы. Современный, расширенный вариант таблицы Менделеева составлен авторами статьи на основании последних решений ИЮПАК - Междунаpодного союза теоpетической и пpикладной химии (International Union of Pure and Applied Chemistry - IUPAC). Эта оpганизация, созданная в 1919 году, кооpдиниpует исследования, тpебующие междунаpодного согласования, контpоля и стандаpтизации, pекомендует и утверждает химическую теpминологию, включая названия элементов. Россия, будучи полноправным членом союза, выполняет его решения и рекомендации. Новая форма таблицы была одобрена XVII Менделеевским съездом в сентябре 2003 года. В таблицу внесены самые последние характеристики всех известных на сегодняшний день элементов. Она будет полезна всем, кто изучает химию и физику или просто интересуется современной наукой.
ИЗ ИСТОРИИ СОЗДАНИЯ И РАЗВИТИЯ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
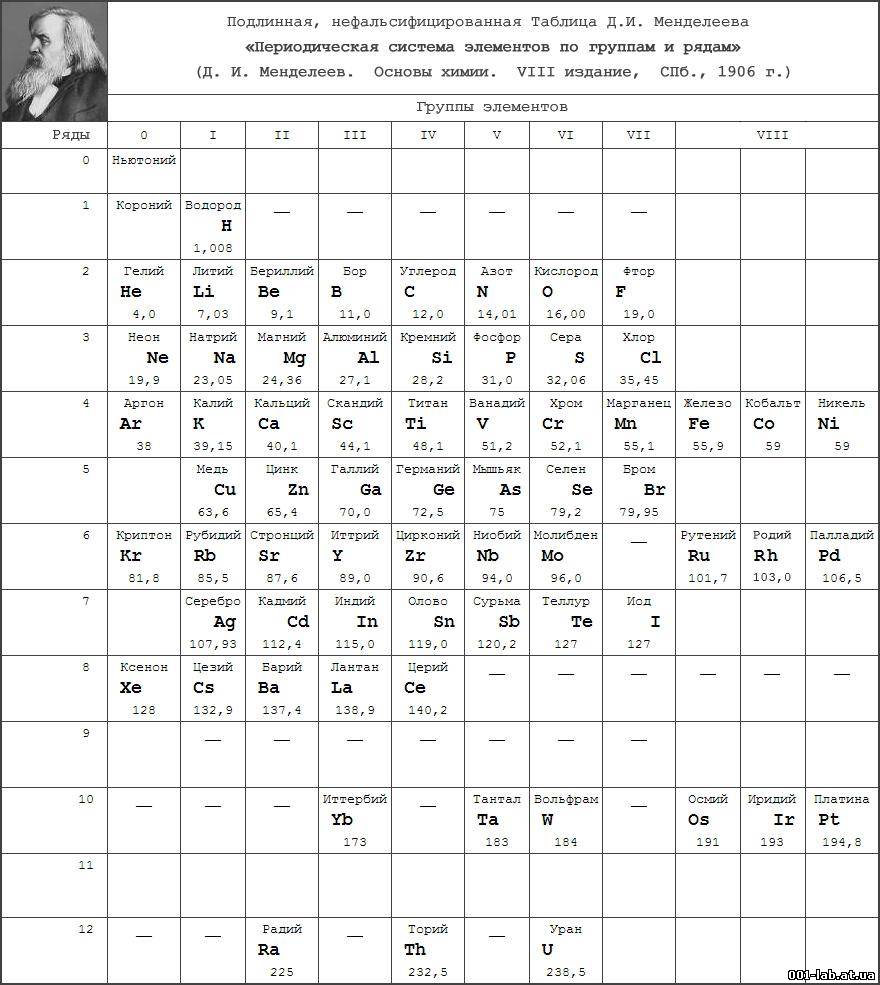
Первого марта 1869 года Д. И. Менделеев обнародовал периодический закон и его следствие - таблицу элементов. В 1870 году он назвал систему "естественной", а спустя год - "периодической". Таблица (далекий прообраз современной), демонстрирующая закон, была представлена Менделеевым под названием "Опыт системы элементов, основанный на их атомном весе и химическом сходстве". Им же была дана формулировка закона: "Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, находятся в периодической зависимости от их атомного веса". Таблица состояла из шести вертикальных групп, предшественниц будущих периодов. По горизонтали прослеживались еще не полные ряды элементов, прообразов будущих подгрупп (сегодня - групп) элементов. Она содержала 67 элементов (сейчас их около 120), в том числе три предсказанных, впоследствии открытых и названных "укрепителями периодического закона".
Естественно, первая таблица была несовершенной, и в последующие годы Менделеев многократно дополнял ее и вносил в ее структуру изменения. В момент представления первого варианта таблицы (март 1869 года) не были еще известны благородные ("инертные") газы (Не, Ne, Ar, Kr, Xe, Rn) и отсутствовали сведения о внутреннем строении атомов. Лишь в двадцатых годах прошлого столетия, после революционных открытий в физике, применения рентгеновских лучей и обнаружения благородных газов, стало возможным дать современное определение закона о периодической зависимости свойств элементов от порядкового номера элемента, а не от атомного веса, как было вначале отмечено Д. Менделеевым. Иными словами, в трактовке закона понятие "атомный вес" элемента было заменено словами "порядковый (или атомный) номер", что отвечает числу протонов в ядре атома и, соответствен но, числу электронов у нейтрального атома. Определение стало отвечать данным об электронном строении атома, диктующим периодическую повторяемость свойств атомов через 2 (s-элементы), 6 (р-элементы), 10 (d-элементы) и 14 (f-элементы) элементов. Эти цифры отвечают максимально возможному числу электронов на определенном энергетическом уровне атома. Они же соответствуют и числу возможных элементов в соответствующем периоде. На первом энергетическом уровне дозволено быть только двум электронам (на s-уровне). Они привели к наличию в первом периоде двух элементов: водорода и гелия. На втором энергетическом уровне восемь разных электронов отвечают появлению восьми новых элементов - от лития до неона. Аналогичная картина наблюдается и в третьем периоде. В нем, вместо ожидаемых восемнадцати, также восемь элементов - от натрия до аргона. Здесь произошла задержка с образованием десяти d-элементов из-за того, что 3d-электроны оказались на более высоком энергетическом уровне, чем 4s-электроны. По этой причине 3d-элементы (скандий, титан и др.) появляются лишь в четвертом периоде после двух 4s-элементов (калий и кальций). Они предшествуют 4р-элементам (от галлия до криптона). Этим объясняется возникновение обобщающего термина - "переходные элементы", "вставная декада". В пятом периоде наблюдается аналогичная картина, в него с опозданием приходят 4d-элементы; они также оказываются переходными. Описанные естественные явления были одной из причин создания таблицы из восьми групп. Однако "запаздывают" также по четырнадцать 4f- и 5f-элементов уже на два периода. Из-за их большего числа и расположения этих электронов в третьем снаружи слое (близость свойств) в обеих обсуждаемых здесь формах таблиц они выделены вне групп. Общее правило при образовании периодов системы - все они начинаются со щелочных металлов с первым ns1-электроном, образующим n-период (n - номер периода системы). Завершает каждый период "инертный" газ с последним np6-электроном. Исключение - первый период системы, он находится всегда на особом положении.
Таким образом, число элементов в семи известных периодах составляет 2, 8, 8, 18, 18, 32, 32. В соответствии с указанными числами будут наполняться элементами все периоды в порядке возрастания их порядковых номеров. При этом один и тот же элемент может оказаться в различных по номеру группах, что заметно при сравнении двух таблиц.
Рассмотренные цифры позволяют создать таблицы, состоящие из 2, 8, 18 или 32 групп элементов в трех вариантах - из (2+6), (2+6+10) или (2+6+10+14) групп. Исторически, как наиболее удобные, распространение получили в первую очередь таблицы, состоящие из 8 или 18 вертикальных групп:
а) Короткая форма таблицы. Она, к сожалению, до сих пор приводится в большинстве российских справочников и учебных пособий, хотя официально отменена ИЮПАК в 1989 году. Таблица состояла из VIII (+0) групп "типических" элементов, подгрупп (иногда и рядов) и периодов элементов. В современной зарубежной литературе эта форма таблицы заменена длинной формой.
б) Длинная (реже называемая длиннопериодной или полудлинной) форма таблицы. Она была утверждена ИЮПАК в 1989 году, состоит из 18 групп, обозначенных арабскими (вместо римских) цифрами, и не содержит "типических" элементов, подгрупп, рядов и семейств. Ее упрощенные варианты появлялись гораздо раньше, но чаще всего с одним отличием - групп, обозначенных римскими цифрами, было восемь (с их растяжкой до восемнадцати за счет приставок а и b и искусственным созданием триад элементов).
в) Сверхдлинная (реже именуемая длинной) форма таблицы состояла бы из 32 групп элементов. Официально она вряд ли будет принята в предвидимом будущем, так как каждая из 14 дополнительных групп (сверх 18) содержала бы лишь два элемента (один лантаноид и один актиноид), близкие по свойствам ко всем остальным тринадцати элементам периода.
НОВАЯ ФОРМА ТАБЛИЦЫ

До 80-90-х годов прошлого века были распространены две первые формы таблицы. Первая - архаичная короткая форма с "насильственной" упаковкой элементов в восемь (I-VIII), иногда девять (+0) групп, подразделенных дополнительно еще на ряды (8 или 10) и подгруппы, содержавшие два или три "типических" элемента, предшествующих, в свою очередь, двум спорным по названиям (A, B или a, b, "главная" или "побочная").
При выборе и утверждении длинного варианта таблицы были соблюдены "интересы" большинства элементов и принцип "золотой середины" без нарушения основы закона Менделеева - периодичности в свойствах элементов. Сорок элементов (по 10 d-элементов в каждом из периодов с 4 по 7), относимые ранее к "переходным", или "вставным" (между s- и p-элементами), и называемые "побочными", после 1989 года перестали быть таковыми. Они стали полноправными компонентами своих новых десяти групп.
С официальным принятием новой формы таблицы исчезли, став лишними, надуманные или принятые вынужденно термины: "типические элементы", "подгруппа" (главная и побочная), "триада", "ряды", "семейства" (железа или платиновых металлов). Все элементы одной группы (кроме водорода и гелия - они всегда на особом положении), расположенные вертикально в один ряд, имеют в принципе одинаковые две наружные (определяющие степень окисления) s- + p- или s- + d-орбитали электронов. Лантаноиды и актиноиды (f-элементы), как и раньше, остаются в третьей группе в соответствии с наличием в их электронных орбиталях условно s2d1-электронов. Различия в электронной структуре атомов актиноидов здесь не обсуждаются.
Длинная форма таблицы лишена несоответствий, недостатков и очевидных противоречий, присущих ее короткой форме, заметных при первом же взгляде на свойства элементов, искусственно собранных в одну и ту же группу. Так, например, в I группу короткой таблицы попали и металлы Cu, Ag, Au,и противоположные по активности щелочные металлы Na, K, Rb, Cs. Несовместимость свойств "одногрупповых" элементов прослеживается и по всем остальным группам. Обратим внимание лишь на бывшие конечные (VI-VIII) группы. Это - соседство в VI группе двух "типических" элементов - O и S и их аналогов Se, Te, Po с тугоплавкими металлами - Cr, Mo, W; в VII группе - элементов, отвечающих агрессивным летучим галогенам F, Cl, Br, I, с не менее тугоплавкими металлами Mn, Tc, Re.
Максимально противоречива структура VIII группы. В нее включены подгруппа VIIIb с "триадой" ("семейство железа" - Fe, Co, Ni) и "семейство платиновых металлов" (Ru, Rh, Pd, Os, Ir, Pt), куда, естественно, должны входить в виде трех вертикальных рядов и только что полученные элементы 108-110, которые никогда не относились к платиновым. В эту же группу входит, противореча здравому смыслу, и подгруппа VIIIa, куда отнесены благородные газы (He, Ne и другие).С уверенностью можно утверждать, что исторически эти триады-семейства были "втиснуты" в прокрустово ложе последней (VIII) группы вынужденно, вопреки логике, так как эта группа, согласно электронной структуре атомов, предназначена природой только для указанных газовых элементов. Причина образования такого "Ноева ковчега" проста: четырем триадам из 3(4) декад в каждом периоде при компоновке таблицы из восьми групп не хватило места в ее предшествующих семи группах.
В официально принятой длинной форме таблицы понятия "семейство железа" и "семейство платиновых металлов" исчезают логически, так как к ним, согласно их свойствам, совместному распространению в природе, изоморфизму и последовательному изменению электронной структуры, можно было бы присоединить соседей по таблице и справа и слева. Иными словами, первое семейство можно расширить, например, до ванадия и цинка включительно, а во второе - поместить другие благородные металлы - серебро, золото, ртуть; старые понятия надуманы искусственно, будучи привязаны к структуре бывшей VIII группы.
В предложенную таблицу для каждого элемента введены также две альтернативные величины относительной электроотрицательности (ОЭО) атомов (их способности в молекуле притягивать электроны, участвующие в образовании химических связей) и основные физические параметры соответствующих простых веществ. Использовать значения ОЭО важно, в частности, для исключения и исправления устаревших ошибочных названий и написания химических формул бинарных соединений. Например, водородные соединения элементов второго периода Н4С, Н3N, H2О, НF согласно значениям ОЭО (для водорода около 2,0, для других элементов - от 2,5 для углерода до 4,0 для фтора) называются соответственно карбидом, нитридом, оксидом и фторидом водорода. В соответствии с этим приведенные написания формул аммиака и метана более справедливы, нежели традиционные (NH3 и СН4).
Однако, несмотря на справедливое разрешение ИЮПАК давно назревшей проблемы и принятие новой системы во всем мире, ее использование в российском образовании и науке неоправданно запаздывает. Вместе с тем есть и отрадные исключения из этого. Помимо ряда изданий нового варианта таблицы, предложенного авторами настоящей статьи, можно отметить публикации простых вариантов длинной формы таблицы рядом передовых российских издательств, а современной таблицы на двух языках - в новом семитомном справочном издании. В отличие от российских, зарубежное образование и наука приняли к исполнению решение ИЮПАК 1989 года незамедлительно. Интернет также сообщает только о наличии длинной формы таблицы.
Современный вариант периодической системы, первый в российских публикациях, был создан в 1999 году. Новая форма таблицы Менделеева учебно-справочного назначения отвечает международным стандартам. Кроме русских и латинских названий элементов в ней приводятся английские и американские формы их написания. Чтобы сохранить преемственность таблиц и упростить использование ее длинной формы, новые номера групп в ней согласованы со старыми (римскими) номерами групп (I - VIII) и подгрупп (a, b), хотя зарубежные источники прежние обозначения уже не указывают. Упрощенные варианты рациональной длинной таблицы были распространены еще задолго до 1989 года, в том числе в СССР, с одним отличием - номеров групп было восемь (они обозначались римскими цифрами), но они "растягивались" до восемнадцати за счет приставок а и b и искусственного создания триад элементов. В новой таблице приведены исправленные атомные массы элементов, утвержденные ИЮПАК в 1995 году, и новые названия десяти последних элементов, окончательно утвержденные, также этой организацией, в 1997-м. Аналоги такой системы, в основном англоязычные, широко распространены в зарубежной литературе.
Авторы благодарныпрофессорам С. Г. Дьяконову,Н. В. Коровину, А. М. Кочневу, А. М. Кузнецову, Г. В. Лисичкину, А. И. Михайличенко, Ю. И. Сальникову, С. Н. Соловьеву, Н. А. Улаховичу, А. И. Хацринову и др., поддержавшим высказанные идеи или давшим полезные советы при оформлении современной таблицы Д. И. Менделеева.
ЛИТЕРАТУРА
Лидин Р. А. и др. Химия в помощь абитуриенту. - М.: Дрофа, 2001. 576 с.
Никольский А. Б., Суворов А. В. Химия. - СПб.: Химиздат, 2001. 512 с.
Новый справочник химика и технолога. - СПб.: НПО "Мир и семья", 2002. Т. 1, 954 с. Т. 2, 1276 с.
Сайфуллин Р. С., Сайфуллин А. Р. Универсальный лексикон: химия, физика и технология; R.S.Saifullin, A.R.Saifullin. Universal Concise Dictionary: Chemistry, Physics andTechnology. - М.: Логос, 2001, 2002. 548 с.
Хаускрофт К., Констебле Э.. Современный курс общей химии/ Пер. с англ. - М.: Мир, 2002. Т. 1, 252 с. Т. 2, 250 с.
Химия, справочник школьника и студента / Коллектив авторов. Пер. с нем. Изд. 2-е. - М.: Дрофа, 2000. 384 с.
Хисамиев Г. Г. Общая химия, задачи и упражнения (для вузов). - Казань: Магариф, 1999. 368 с.
Эмсли Дж. Элементы. - М.: Мир, 1993. 258 с.
Oxford Dictionary of Science / Ed. Isaacs A., Daintith J., Martin E. Oxford University Press, Oxford, New York, 1999. 858 p.
The New Encyclopedia Britannica, 15-th Ed., Encyclopedia Britannica, Inc. Chicago, 1974-1994.
Hawley's Condensed Chemical Dictionary, 11-nd Ed Rev. N.I. Sax, R.J. Lewis, Sr. Van Nostrand Rheinhold Co., N.Y., 1987. 1303 p.
WebElementsTM Periodic table (professional edition) (http://www.webelements.com/. 1993-2003).
Krzysztof M. Pazdro, Chemia dla licealistov (Budowa materii w ochach chemika), Wyd. II. Oficyna Edukacyjna, Warszawa, 1996. 246 p.