Прионы: чем на самом деле опасны молекулы-зомби
«Самое страшное в них то, что они действуют не как хищники, а как вирусы. Хищники по природе своей разумны и не уничтожают всех жертв поголовно... А они – просто размножаются, заражают и пожирают. Все остальное им совершенно безразлично», – так объясняет свой ужас перед зомби автор бестселлера «Мировая война Z» Макс Брукс. Но то же можно сказать и о прионах – настоящих смертоносных молекулах-зомби.
Сравнение с ходячими мертвецами напрашивается. Как и они, прионы в буквальном смысле слова разрушают мозг, превращая человека сперва в овощ, а затем — в труп. Как зомби из людей, так и они появляются из самых обычных белков. Их крайне сложно уничтожить, зато сами они смертельны в ста процентах случаев. Впрочем, трудно было бы ожидать иного от инфекционных агентов, которых вообще нельзя назвать живыми. Несколько столетий они ускользали от ученых — и даже потом в их существование поверили далеко не сразу. А теперь в них иногда видят даже источник жизни.
Овцы и людоеды
Первое «нашествие зомби» отмечено на рубеже XVII и XVIII веков, когда в Англии вовсю громыхала промышленная революция. Среди огромных стад, снабжавших шерстью быстрорастущие текстильные предприятия, то и дело стали попадаться «паршивые овцы». Напасть развивалась медленно, но неотвратимо: животные мучительно, до крови чесались об ограду, затем нарушалась координация движений, чаще и чаще случались судороги — через неделю-месяц все заканчивалось смертью.
Прошли столетия, Пастер описал бактериальные инфекции, а после работ Ивановского и Бейеринка появились представления и о вирусных заболеваниях. Но «почесуха овец», или скрейпи, оставалась загадкой. Все говорило о поражении мозга, ткани которого болезнь превращала в нечто, похожее на губку, изъеденную неровными порами. Но на вопрос о ее возбудителе специалистам оставалось лишь разводить руками: ни бактерий, ни вирусов найдено не было. Зато нашлись у скрейпи последователи.
В одном и том же 1920 году, но независимо друг от друга, Ганс Крейтцфельдт и Альфонс Якоб описали неизлечимое и неумолимое поражение нервной системы человека. Возникая по неизвестной причине, обычно в пожилом возрасте, болезнь часто начиналась проблемами со сном и ослаблением когнитивных функций, развивалась потерей координации движений и деменцией, а несколько лет спустя венчалась параличом и функциональными нарушениями, окончательно несовместимыми с жизнью. Ткани мозга снова напоминали губку — и снова никаких следов возбудителя.
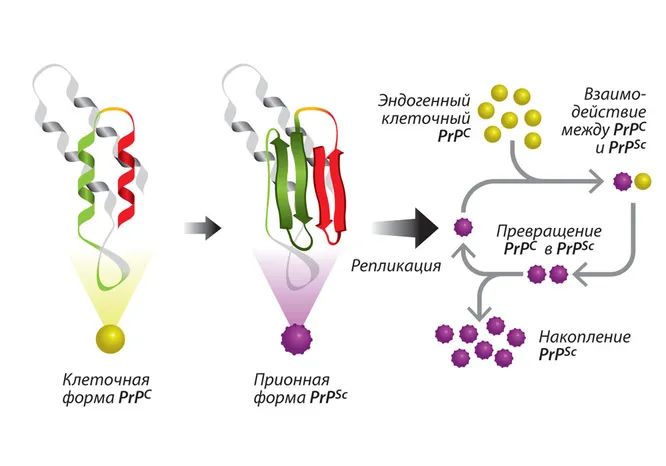
Структура «здорового» белка PrPC содержит участок из трех альфа-спиралей и двухцепочечного антипараллельного бета-слоя. У «больной» формы PrPSc этот домен образован преимущественно бета-слоями. Такую структуру можно назвать «заразной»: ее появление стимулирует нормальные молекулы PrPC переходить в такую же аномальную форму PrPSc. Поодиночке мономеры PrPSc не существуют и складываются в весьма устойчивые амилоидные образования из десятков, сотен и тысяч частиц. Расщепляясь на фрагменты, эти образования распространяются и «инфицируют» новые молекулы PrPC.
Редкое заболевание могло изучаться еще долго и неторопливо, не создавая особенного ажиотажа, если бы у него не обнаружился странный родственник в противоположной части света. В начале 1954 года чиновники Новой Гвинеи, тогда еще бывшей частью Австралии, составили отчет, в котором сообщали о вспышке диковинной местной болезни куру. «Первым признаком надвигающейся смерти становится слабоумие, за которым следует общая слабость вплоть до неспособности самостоятельно стоять на ногах, — говорилось в сообщении. — На следующем этапе жертва лежит, не в силах даже принять помощь, пока, наконец, не наступит гибель». Описанием болезни занялись медики Винсент Зигас и Карлтон Гайдушек, выяснившие, что поражает она лишь одно из новогвинейских племен, форе, выделяющееся среди соседей своим пристрастием к каннибализму. Вряд ли можно считать эту традицию какой-то особенно жестокой: существование в условиях серьезного дефицита жизненных ресурсов порождает и не такие обычаи. Так что после смерти аборигена форе его родственники поедали останки, причем по традиции мясо доставалось мужчинам, а женщины и дети довольствовались остальным, в том числе и мозгом. Как правило, заболевали именно они, причем мозг поражался в первую очередь: губчатая масса переродившейся нервной ткани была все той же, что и при скрейпи овец, и при болезни Крейтцфельдта-Якоба. Так что вскоре врачи решили, что имеют дело с медленной вирусной инфекцией, которая поражает нервную ткань и передается алиментарным путем (как «зомбированность»), через поедание больного мозга. Только вот выделить вирус снова никак не удавалось.
Коровы и радиация
Сходство болезней (необычно долгий инкубационный период и неизбежность летального исхода, заразность и, конечно, характерные перерождения нервной ткани мозга) позволило предположить у них и общую причину и объединить в группу трансмиссивных губчатых энцефалопатий.

Инкубационный период скрейпи может растянуться на годы. Но как только у животного начинают проявляться первые симптомы, можно быть уверенным, что через несколько недель наступит смерть.
Уже в 1960-х британские ученые предположили, что источником их может оказаться белок: таинственный инфекционный агент не инактивировался смертельной даже для вирусов дозой излучения. Это можно было объяснить крошечным размером его частиц, намного меньших, чем даже вирусы. Гипотеза показалась не лишенной смысла, хотя в корне противоречила «основной догме молекулярной биологии», которая постулировала однонаправленный поток информации, свойственный всему живому: от ДНК через РНК к белку. Возможно ли выбросить из этой короткой цепочки целых два звена — и сохранить многие свойства живого? В 1970-е поисками возбудителя занялся калифорнийский невролог Стэнли Прузинер. Работа шла небыстро: используя биологические жидкости больных скрейпи овец, ученые подтвердили, что болезнь неумолима и развивается у всех до единой зараженных мышей, хотя инкубационный период затягивается на полгода, а то и дольше. Зато результаты многолетних экспериментов оказались сенсационными: снова и снова, выделяя прежде неуловимый инфекционный агент, ученые убеждались, что это «голый» белок.
Зомби по наследству
Болезнь Крейтцфельдта-Якоба, синдром Герстмана-Штраусслера-Шейнкера и другие прионные заболевания (а известно их уже несколько десятков) различаются не только характером поражения и течения, но и механизмами возникновения. Считается, что одни из них чаще развиваются в результате спонтанного возникновения в клетке PrPSc или получения его с пищей, а другие имеют генетическую природу. Впервые «передача зомби по наследству» обнаружилась на рубеже 1970-х и 1980-х годов, когда настойчивый итальянский доктор Игнацио Ройтер провел собственное «расследование» смерти родственниц своей жены, умерших от крайне редкой причины — фатальной бессонницы. После смерти одного из родичей мозг его был изучен и обнаружена мутация в 178-й позиции гена PRNP. Неправильная, склонная к «прионному перерождению» конформация PrPС передается по наследству и обычно дает о себе знать уже в зрелом возрасте, когда человек начинает страдать от все более тяжелой бессонницы и угасает за считаные месяцы. Сегодня фатальная бессонница диагностирована в 40 семьях — приблизительно у сотни человек.
Принять такое удалось не сразу. Шутка ли: патоген, не имеющий даже намека на ДНК, а между тем — инфекционный, размножающийся и, как покажут дальнейшие исследования, даже мутирующий. Признание случилось во многом по пословице: «Не было бы счастья, да несчастье помогло». В конце 1980-х в Великобритании разразилась эпидемия губчатой энцефалопатии крупного рогатого скота — «коровьего бешенства». Болезнь распространилась так широко, что за следующие годы ее обнаружили почти у 200 000 голов, было зафиксировано несколько сотен случаев передачи ее людям. И это, определенно, был белок: коровам он мог передаться от овец или появиться в сообществе случайно, а затем распространиться через кормовые добавки, произведенные из костной муки забитых животных. В результате в 1990-х прионы, как назвал смертоносные белки Прузинер, скрестивший слова «протеин» и «инфекция», получили почти всеобщее признание, а в 1997 году сам ученый удостоился Нобелевской премии. Вызывавший губчатые энцефалопатии «прионный белок скрейпи» PrPSc был выделен и охарактеризован, а вскоре нашли и его здорового предшественника, который — уникальный случай! — получил имя в честь своего аномального родственника, став «клеточным прионным белком» PrPС. Он встречается на мембранах клеток во многих частях тела и тканях здоровых людей и животных, хотя больше всего — в клетках нервной системы, как в самих нейронах, так и в поддерживающих их клетках нейроглии. Судя по всему, он исключительно важен, но для чего?

Прионы: смертоносные молекулы-зомби
Явление зомби
Было показано, что PrPС обладает высоким сродством с ионами меди, что может указывать на его возможную роль в удалении из клетки токсичных для нее тяжелых металлов. С другой стороны, максимальная концентрация PrPС наблюдается у контактов между нейронами некоторых областей мозга. Клеточные мембраны здесь буквально усеяны этим белком, что, возможно, говорит о том, что он играет какую-то роль в формировании или стабилизации синаптических контактов. Другая группа гипотез говорит о том, что PrPС необходим для удаления «загрязнений» с поверхности клеток. Связывая их, белок меняет форму, и, когда на мембране нейрона накопится достаточно много таких измененных белков, в нем запускается механизм уничтожения, а клетка гибнет.
«Существует, наверное, 20 или 30 гипотез о том, какую именно задачу может выполнять нормальная клеточная форма прионного белка. Но какой-то определенной, четкой функции у него не найдено, поэтому и возникают дебаты, — рассказал нам профессор Медицинской школы Мэриленда Илья Баскаков, не один год посвятивший изучению прионов и прионных болезней. — В последние годы активно обсуждается возможная роль PrPС в процессе развития нервной системы. Он может быть необходим для того, чтобы из стволовых клеток созревали новые нейроны — эксперименты показали, что, если у стволовой клетки выключен кодирующий этот белок ген PRNP, она не может превратиться в нервную».
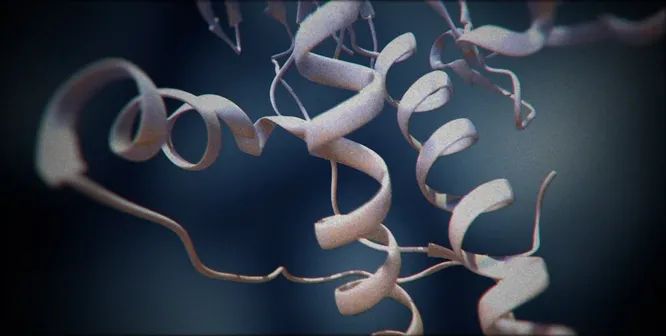
Функции здорового белка остаются неизвестными, но они явно очень важны: ген PRNP характеризуется высокой консервативностью и мало отличается у людей и других млекопитающих. Теоретически это и позволяет приону передаваться между любыми видами животных, имеющими PrPС, — недаром губчатые энцефалопатии зафиксированы не только у людей, овец и коров, но и у кошек, норок, антилоп, оленей и даже страусов. Предполагается, что первый белок-«зомби» в популяции может появиться случайно, в результате неправильно сложившейся пространственной формы здорового белка PrPС. Эта ошибка, на первый взгляд незначительная, меняет все.
Подобно зомби, ряды которых множатся с каждым укусом, инфекционная форма PrPSc приводит к перерождению нормальных молекул PrPС в новые прионы — процесс развивается как автокаталитическая реакция, продукты которой сами ускоряют ее. Как и зомби, прионы любят «ходить» бесчисленными ордами: частицы PrPSc складываются одна на другую стопками, образуя весьма устойчивые волокна, так что каждый конец такого образования становится центром притяжения для все новых и новых прионов.
«По одиночке, мономерами, PrPSc вообще не встречается, — говорит Илья Баскаков, — они существуют лишь в форме агрегатов-мультимеров. Показано, что самая маленькая частица PrPSc может состоять примерно из шести мономеров, но, вырастая, они доходят до сотен и тысяч единиц». Достигнув больших размеров, белковое волокно разламывается на множество новых фибрилл, каждая из которых становится зародышем новой армии зомби-прионов. Подавленная скоплениями этих бляшек клетка гибнет, а PrPSc распространяются дальше. Уничтожить их крайне непросто: эксперименты показали, что прионы невероятно устойчивы не только к радиации, но и к нагреванию, и даже к действию мощных клеточных ферментов-протеаз.
Инкубационный период у болезни Крейтцфельда–Якоба настолько длительный, что некоторые люди, получившие прионный белок еще во время вспышки «коровьего бешенства» 1980-х годов, лишь теперь начинают демонстрировать симптомы заболевания.
Обломки PrPSc могут попадать в организм и извне, через биологические жидкости и ткани больных животных, во время некоторых медицинских процедур и просто с пищей. Большинство переродившихся белковых частиц, видимо, разрушается в желудочно-кишечном тракте, но некоторым удается добраться к месту действия, преодолев даже гемато-энцефалический барьер, стоящий на границе между кровью и тканями мозга. Способность PrPSc проходить сквозь эту весьма надежную преграду остается одной из главных его загадок.
Добрые монстры
Такие свойства характерны не только для PrPС — даже у дрожжей найден свой «прионный белок» Ure2, способный переходить в нестандартную, но крайне устойчивую амилоидную форму. Возможно, это неспроста: «Прионы могут и не быть патогенными, — написал по этому поводу исследователь Рэндал Халфманн, — они могут играть роль "не-нуклеиновой", белковой наследственности у здоровых клеток и организмов». В подтверждение этой идеи Халфманн и его коллеги показали, что дрожжевой белок Ure2, приобретая нестандартную конформацию, влияет на целый ряд сигнальных путей клетки, в том числе и на активность гена FLO11. В свою очередь, синтезируемый на этом гене белок Flo11p необходим клеткам дрожжей для того, чтобы «сцепляться» друг с другом, формируя устойчивые к неблагоприятным условиям пленки. Так «прионное перерождение» белка Ure2 может способствовать адаптации и выживанию клеток.
Прионы: смертоносные молекулы-зомби
Еще одну ложку меда к бочке прионного дегтя добавили работы Джеймса Чена и его коллег. Исследователи показали, что белок MAVS, один из необходимых для работы нашей иммунной системы, переходит в амилоидную прионную форму не во зло, а исключительно во благо. Обнаружив инфицированную определенными вирусами клетку, он «оседает» в ней, и его накопление служит сигналом к усиленному синтезу интерферонов и привлечению макрофагов для уничтожения зараженной клетки вместе со всем ее опасным содержимым.
«На этот счет существует интересная гипотеза, которая указывает на то, что такие амилоидные формы могут иметься вообще у всех белков, что это общее свойство полипептидных цепей, — продолжает Илья Баскаков. — Мало того, такие структуры наиболее стабильны. Поэтому высказано предположение о том, что именно в таких формах белки могли существовать в "пребиотическом супе", в котором некогда проходила химическая эволюция молекул и зарождалась жизнь». Действительно, некоторые эволюционисты полагают, что амилоидные конформации белков обладают всеми ключевыми способностями, необходимыми для роли «предков жизни». Они способны изменяться и размножаться, выполнять определенные функции, передавая свои особенности следующим поколениям. Если эта идея справедлива, то мы живем в очень странном мире, где все живое появилось на свет от странных и опасных белков, которые сегодня мы можем воспринимать не иначе как безжалостных зомби.